变异与逃逸
新冠病毒的大规模流行是的新的变异毒株不断涌现,Alpha、Beta、Gamma、Delta、Omicron等,其中一些突变株具有更强的感染能力或更强免疫逃逸能力。一直以来,对于COVID-19及其突变体的研究大部分集中在S蛋白上,而非刺突蛋白一直未获得充分研究,故不清楚对于具有相同S蛋白序列的同一变体的不同亚型表现出不一样的致病率。

非刺突蛋白结构新研究
美国马里兰大学医学院发现,COVID-19上的非刺突蛋白结构nsp6蛋白对人类细胞具有强毒性,是破坏心脏组织细胞的元凶。同时,美国波士顿大学、哈佛医学院、威斯康星大学的联合研究发现COVID-19上的非刺突蛋白结构nsp6蛋白突变是Omicron治病性较弱的重要原因,而S蛋白对Omicron的较低致病性的贡献微乎其微,为治疗新冠病毒提供新思路,为新冠疫苗和药物开发提供新方法。
在该研究中,研究小组将Omicron上的S蛋白与原始毒株融合,构建新型嵌合毒株Omi-S,对比分析Omi-S、原始毒株和Omicron的感染能力和致死率。发现Omi-S的感染能力弱于原始毒株、病毒滴度明显高于Omicron;感染原始毒株的小鼠死亡率高达100%,Omicron只会导致小鼠出现轻微症状而不会致死,Omi-S则会让小鼠的死亡率高达80%。这说明了S蛋白对Omicron的致病能力影响很小。进一步的,研究小组将Omicron的nsp6蛋白构建至到Omi-S的嵌合病毒上,组成Omi-S plus nsp6病毒。经过验证发现Omi-S plus NSP6病毒复制明显减少,感染动力学与Omicron相似。
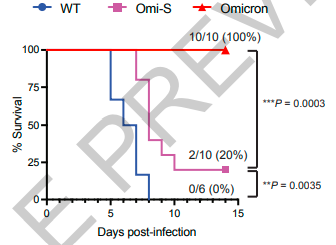
非结构蛋白nsp6主要促进受感染细胞中某些膜囊泡的形成,这些膜囊泡充当病毒基因组扩增的工厂。S蛋白包含2个结构域:S1与ACE2受体相互作用,S2负责与膜融合。另外,研究发现nsp6蛋白与炎症有关,会导致心脏细胞受损。
综上,发现了Omicron致病性较弱的原因,开辟了消灭COVID-19的新途径,S蛋白和nsp6蛋白可作为药物治疗潜在靶标。
高通量蛋白相互作用研究方法
Aurora 开发的VERSA SPOTTER平行多肽阵列合成仪,支持化学固相合成法,可可制备极高密度的肽阵列。合成使用试剂量少,仪器操作简便,可满足顾客构建多肽文库需求,研究蛋白质–核酸、蛋白质–蛋白质、蛋白质–药物等各类互作的首选,在疫苗开发、药物研发方面极具灵活性。

参考文献:
- Zhu J, Wang G, Huang X, et al. SARS-CoV-2 Nsp6 damages Drosophila heart and mouse cardiomyocytes through MGA/MAX complex-mediated increased glycolysis[J]. Communications biology, 2022, 5(1): 1-15.
- Chen D Y, Chin C V, Kenney D, et al. Spike and nsp6 are key determinants of SARS-CoV-2 Omicron BA. 1 attenuation[J]. Nature, 2023: 1-3.


